Os tumores ósseos primários representam uma pequena parcela dos tumores em geral. Os sarcomas compõem um grupo de tumores heterogêneos bastante raros, um tipo de câncer que se desenvolve a partir de tecidos como ossos e músculos. E mesmo os ossos e os músculos corresponderem a 75% do peso corporal total, os tumores primários representam menos de 1% de todos os tumores dos adultos e de 3 a 8% dos tumores malignos pediátricos.
Por muito tempo a amputação do membro afetado era o tratamento mais indicado na presença desses tumores. A amputação, embora seja reconhecida como agressiva, era o tratamento que apresentava o melhor resultado até os anos 70 quando ainda não havia a opção de terapias adjuvantes como a quimioterapia e a radioterapia. Ainda assim, a taxa de sobrevida de 5 anos desses pacientes submetidos à cirurgia era menor de 20%, ou seja, mesmo após amputação registrava-se uma taxa de óbito alta por disseminação pulmonar.
Hoje a possibilidade da preservação de membros é uma realidade e o marco inicial do progresso para os pacientes portadores de osteossarcoma foi a introdução dos protocolos quimioterápicos. Fazendo com que as abordagens cirúrgicas se tornassem mais precisas. A terapia completa (quimioterapia, radioterapia e cirurgia) foi se aperfeiçoando cada vez mais fazendo com que diagnóstico e estadiamento ficassem cada vez mais certeiros aumentando as soluções terapêuticas.
Os tumores ósseos primários da criança e do adolescente acometem na maioria das vezes os ossos longos, principalmente na região do joelho.
O Grupo de Tumores Ósseos Primários é dividido em:
- Osteossarcoma → 56 %
- Tumores de Ewing → 34%
- Condossarcomas → 6%
- Outros tumores malignos específicos → 4%
OSTEOSSARCOMA
O osteossarcoma é o sarcoma primário do osso, sendo o mais comum em crianças, representando aproximadamente 20% de todos os sarcomas. Acomete a região metafisária de ossos longos sendo que em 50% dos casos atinge o joelho.
A incidência ocorre entre os 10 e 20 anos de idade com pico na adolescência, na fase do estirão puberal. A prevalência é maior nos meninos do que nas meninas.
Os fatores prognósticos estão relacionados à presença de metástases. 20% dos pacientes possuem metástases já ao diagnóstico sendo a do pulmão a mais comum e significativa. A fisioterapia desenvolve papel importante diante da complexidade destes casos para oferecer ao paciente condições pós operatórias adequadas com objetivo de manter bem estar global com a melhor função possível.
A raridade dos casos e as diversas soluções disponíveis fazem de quase todos os pacientes procedimentos inéditos. Dificilmente encontramos dois casos similares de osteossarcoma, fazendo a comunicação da equipe multiprofissional ser fundamental para o sucesso do tratamento.
OSTEOSSARCOMA: PLANO DE TRATAMENTO
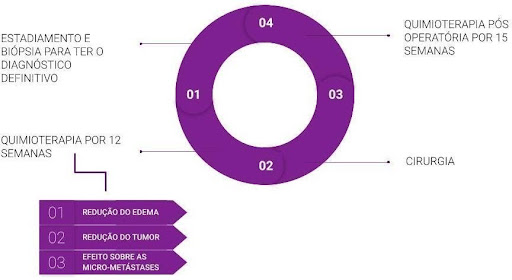
O plano de tratamento inicia-se com a Quimioterapia Neoadjuvante, onde a criança ou adolescente é submetido a 12 ciclos de QT pré-operatória. Que possui função de redução do edema e do tumor, gerando efeitos sobre as micro-metástases que podem não aparecer nos exames de imagem. Após os ciclos de QT, o paciente passa por um intervalo e ao apresentar estado clínico adequado e recuperado é encaminhado para a cirurgia. Após cicatrização cirúrgica e novo intervalo, o paciente passa por mais 15 ciclos de QT pós-operatória.
SARCOMA DE EWING
A família de tumores de Ewing compreende uma neoplasia indiferenciada, derivada de células embrionárias:
- Pelve, fêmur, tíbia e úmero.
- Idade: 5 – 20 anos (raro antes dos 5 e após 30)
- Sexo: M > F
- 6% do total dos tumores ósseos malignos
- Invade partes moles formando um tumor com grande volume
O sarcoma de Ewing possui predileção pela diáfise dos ossos longos, ao contrário dos osteossarcomas. Para o protocolo de tratamento a quimioterapia também será administrada pelo menos por 9 semanas antes da cirurgia ou da radioterapia e é novamente aplicada após ressecção cirúrgica (geralmente um total de 14 a 15 ciclos).
Com os novos protocolos de quimioterapia a taxa de sobrevida livre de doença do osteossarcoma tem melhorado muito nos últimos anos..
TRATAMENTO DOS SARCOMAS ÓSSEOS
O tratamento dos sarcomas ósseos vai depender de:
- Diagnóstico preciso;
- Estadiamento tumoral – se é uma doença localizada ou metastática;
- Protocolo de tratamento adequado.
Cada tipo histológico possui condutas diferentes. Hoje em grande parte do Brasil é utilizado o Protocolo do Grupo de Tratamento Brasileiro de Osteossarcoma. Todos os brasileiros são submetidos, numa fase inicial, ao mesmo tipo de tratamento.
PRINCÍPIOS DA CIRURGIA ONCOLÓGICA
O principal objetivo da cirurgia oncológica curativa é remover o tumor primário com margens adequadas. A cirurgia não é econômica, o que pode levar a grandes defeitos ósseos que precisarão de substituição. Quando o tumor é removido é necessária uma solução protética ou biológica. Existem 4 tipos principais de cirurgias.
- Intralesional (curetagem)
- Marginal (potencialmente contaminada)
- Ampliada (zona racional respeitando a margem)
- Radical (todo o compartimento)
Normalmente é mais utilizada a cirurgia ampliada, quando se retira todo o tumor e a zona reacional em volta do tumor, e a radical.
AMPUTAÇÕES
Indicações para casos de amputações:
- Má resposta à quimioterapia.
- Acometimentos do feixe vásculo nervoso.
- Imaturidade esquelética (discrepância dos membros).
- Perda muscular extensa.
COMO REABILITAR O PACIENTE ONCOLÓGICO ORTOPÉDICO
O tratamento de sarcomas ósseos é bem sucedido hoje porque inclui:
- Preservação máxima da função física;
- Desafios adaptativos incomuns;
- Maturação esquelética;
- Mudança física, psicológica, social e vocacional.
Lidamos com esqueletos em desenvolvimento e por vezes essas crianças poderão ser submetidas a vários procedimentos conforme o esqueleto cresce. Portanto, os protocolos criados precisam ser fáceis de implementar e passíveis de adaptação de acordo com as necessidades individuais do paciente.
DESSENSIBILIZAÇÃO E ENFAIXAMENTO DO COTO
Ambos procedimentos se iniciam logo após a retirada dos pontos e cicatrização adequada. O que pode estar comprometido, principalmente se a criança tiver tido necessidade de iniciar quimioterapia antes mesmo da retirada dos pontos, o que pode acontecer a variar do estadiamento da doença.
A quimioterapia retarda o processo de cicatrização uma vez que promove neutropenia no paciente o predispondo a infecções. É necessário reforçar a necessidade de liberação médica para tais procedimentos a partir de discussão multidisciplinar, tanto com o oncologista quanto com o ortopedista, tendo em vista que a recuperação de hemograma e estabilidade clínica são essenciais para o paciente oncológico.
Essa criança possui perfil no qual a doença e o tratamento quimioterápico ou radiológico já irão consumir de forma importante, toda reserva energética, portanto, prevenir maiores complicações e infecções sempre será o maior objetivo, mesmo que para isso precisemos atrasar determinados procedimentos que julgamos essenciais.
CINESIOTERAPIA (FORTALECIMENTO MUSCULAR, AUMENTO DE FLEXIBILIDADE E PROPRIOCEPÇÃO)
A reabilitação motora inicia-se desde o momento pré cirúrgico com exercícios ativos para ambos os membros inferiores, resistidos ou não, com objetivo de ganho de força muscular ponderal, aumento de flexibilidade e manutenção da amplitude de movimento.
É sempre necessária a verificação do hemograma mais recente do paciente para determinação das abordagens fisioterapêuticas escolhidas. Uma vez que, se a criança possuir níveis muito baixos de plaquetas ou hemoglobinas (questões que podem ocorrer tanto devido a doença quanto por conta do próprio tratamento), não estará indicado treino resistido com cargas significativas, sendo talvez o momento de trazer o enfoque para terapias voltadas para função pulmonar, alongamentos e adequação postal.
O paciente não ficará inativo ou em repouso, sempre existe o que pode ser trabalhado nestes casos, algo mais intenso quando o paciente e seus exames permitem, e algo mais leve e aeróbico nos momentos em que for necessário.
Após a cirurgia a fisioterapia respiratória e motora já tem seu início dentro da unidade de terapia intensiva, desde manter este paciente em ortostatismo realizando adequação postural e descarga de peso, quanto fortalecimento e prevenção de encurtamentos em região do coto.
Manter força muscular adequada e qualidade do coto é fundamental, mas um dos principais objetivos após é a manutenção ou melhora do condicionamento cardiorrespiratório desta criança, principalmente pensando que após os 12 ou 15
ciclos de quimioterapia o paciente precisará estar recuperado e pronto para o processo de protetização. Isso pode ser realizado através de exercícios ativos em cadeia cinética aberta ou fechada, baseado em métodos como pilates, subida e descidas de escadas mesmo que utilizando muletas, bicicletas ergométricas, yoga, entre outras atividades.
Uma vez que verifico os exames atuais do paciente e o encontro com disposição física, a liberdade e a imaginação para tratá-lo da forma mais divertida possível, respeitando seus limites, fica a critério do fisioterapeuta responsável.
QUANDO PROTETIZAR?
Entre quatro e seis semanas após o final das sessões de quimioterapia, o paciente já obterá hemograma e sistema imunológico recuperados para início de protetização de forma propriamente dita.
É sempre importante falar que o processo de protetização já se inicia desde o momento no qual o paciente descobre sobre uma possível amputação. Pensando principalmente em questões como orientações e direcionamento no tratamento fisioterapêutico que facilitarão o encaixe do coto dentro da prótese.
Orientações e discussões sobre a prótese e a reabilitação como um todo são fundamentais de acontecerem desde o momento do diagnóstico de câncer com este paciente e sua família, e por isso a assistência multidisciplinar é tão importante.
REFERÊNCIAS:
- Ieguchi M, Hoshi M, Aono M, Takada J, Ohebisu N, Kudawara I, et al. Knee reconstruction with endoprosthesis after extra-articular and intra-articular resection of osteosarcoma. Jpn J Clin Oncol. 2014;44(9).
- Shehadeh A, Dahleh M El, Salem A, Sarhan Y, Sultan I, Henshaw RM, et al. Standardization of rehabilitation after limb salvage surgery for sarcomas improves patients’ outcome. Hematol Oncol Stem Cell Ther. King Faisal Specialist Centre & Research Hospital; 2013 Sep;6(3–4):105–11.
- Houdek MT, Watts CD, Wyles CC, Rose PS, Taunton MJ, Sim FH. Functional and oncologic outcome of cemented endoprosthesis for malignant proximal femoral tumors. J Surg Oncol. 2016;114(4). Lopresti M, Rancati J, Farina E, Bastoni S, Bernab B, Succetti T, et al. Il percorso riabilitativo del paziente sottoposto a intervento di protesi da grandi resezioni di ginocchio per neoplasia scheletrica. Recenti Prog Med. 2015;106(8):385–92.
- Hwang JS, Mehta AD, Yoon RS, Beebe KS. From amputation to limb salvage reconstruction: Evolution and role of the endoprosthesis in musculoskeletal oncology. Journal of Orthopaedics and Traumatology. 2014. p. 81–6.
- Penna V, Toller EA, Becker RG, Pinheiro C. Uma nova abordagem para as endopróteses parciais de joelho em sarcomas primários ósseos TT – A new approach to partial knee endoprosthesis in primary bone sarcomas. Rev bras ortop [Internet]. 2009;44(1):46–51.
- Albergo JI, Gaston CL, Aponte-Tinao LA, Ayerza MA, Muscolo DL, Farfalli GL, et al. Proximal Tibia Reconstruction After Bone Tumor Resection: Are Survivorship and Outcomes of Endoprosthetic Replacement and Osteoarticular Allograft Similar Clin Orthop Relat Res. 2017 Mar 21;475(3):676–82.
- Tsai LY, Godoy FAC, Petrilli M de T, Viola DCM, Korukian M, Jesus- Garcia Filho R, et al. Protocolo fisioterapêutico em pacientes submetidos à endoprótese não convencional de joelho por osteossarcoma: estudo prospectivo TT – Physiotherapy protocol in patients submitted to non-conventional endoprosthesis of the knee due to osteosarcoma. Rev bras ortop. 2007;42(3):64–70.
- Lewis VO. Limb salvage in the skeletally immature patient. Curr Oncol Rep [Internet]. 2005;7(4):285–92. Available from: http:// www.ncbi.nlm.nih.gov/pubmed/15946588
- Gosheger G, Gebert C, Ahrens H, Streitbuerger A, Winkelmann W, Hardes J. Endoprosthetic reconstruction in 250 patients with sarcoma. Clin Orthop Relat Res. 2006;450(450):164–71.
- Tanaka MH, Penna V, Chung WUTU, Lopes A. Artigo original Tumores Malignos Primários dos Ossos. 1994;26:18–21.
- Kim LD, Bueno FT, Yonamine ES, Próspero JD de, Pozzan G. Bone metastasis as the first symptom of tumors: role of an immunohistochemistry study in establishing primary tumor. Rev Bras Ortop [Internet]. Sociedade Brasileira de Ortopedia e Traumatologia; 2018;53(4):467–71. Available from: https://doi. org/10.1016/j.rboe.2018.05.015.